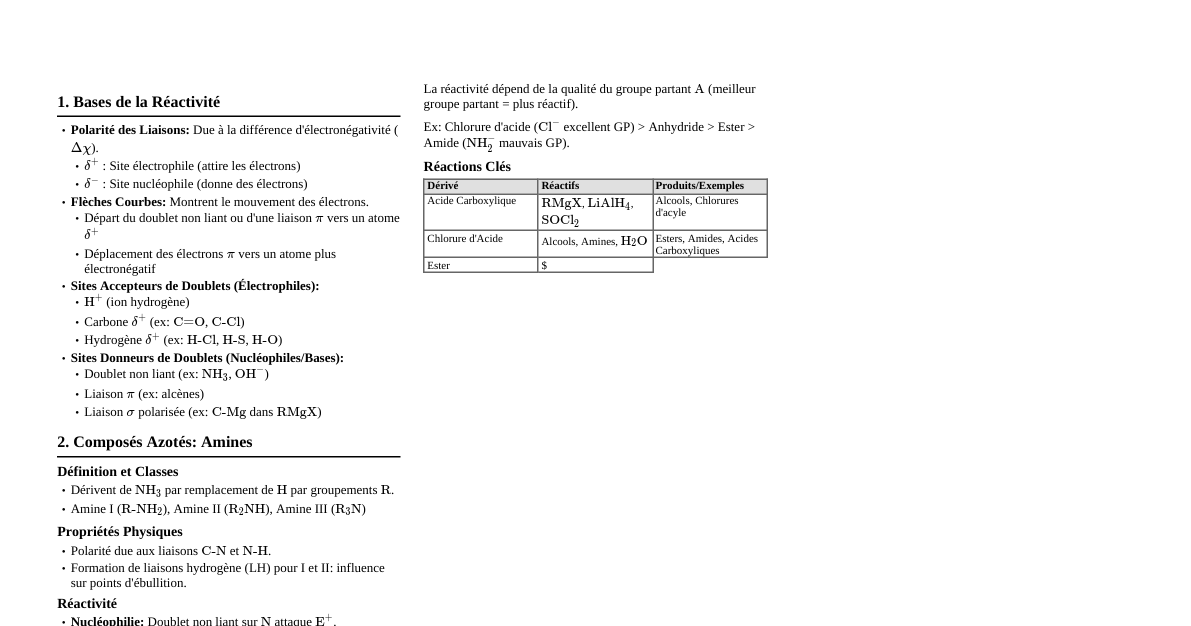
### Mécanique Newtonienne #### 1. Lois de Newton - **Première loi (Inertie):** Si la somme vectorielle des forces extérieures agissant sur un corps est nulle, alors son vecteur vitesse est constant (corps au repos ou en mouvement rectiligne uniforme). $\sum \vec{F}_{ext} = \vec{0} \implies \vec{v} = \text{constante}$. - **Deuxième loi (Relation Fondamentale de la Dynamique):** La somme vectorielle des forces extérieures agissant sur un corps est égale au produit de sa masse par son vecteur accélération. $\sum \vec{F}_{ext} = m \vec{a}$. - **Application:** Étude du mouvement des corps (chute libre, mouvement sur plan incliné, satellite). - **Troisième loi (Action-Réaction):** Si un corps A exerce une force $\vec{F}_{A/B}$ sur un corps B, alors le corps B exerce une force $\vec{F}_{B/A}$ sur le corps A telle que $\vec{F}_{A/B} = -\vec{F}_{B/A}$. - **Application:** Interactions entre objets, propulsion. #### 2. Énergie Mécanique - **Énergie Cinétique:** $E_c = \frac{1}{2} m v^2$. - **Énergie Potentielle de Pesanteur (EPP):** $E_{pp} = mgz$ (où $z$ est l'altitude par rapport à un niveau de référence). - **Énergie Mécanique:** $E_m = E_c + E_{pp}$. - **Conservation de l'Énergie Mécanique:** Si seules des forces conservatives (comme le poids) travaillent, alors $E_m = \text{constante}$. - **Application:** Analyse des mouvements sans frottements, détermination des vitesses. - **Théorème de l'Énergie Cinétique:** $\Delta E_c = \sum W(\vec{F}_{ext})$. Le travail des forces non conservatives (frottements) modifie $E_m$. - **Application:** Calcul de l'énergie dissipée par les frottements. #### 3. Travail et Puissance - **Travail d'une force constante:** $W(\vec{F}) = \vec{F} \cdot \vec{AB} = F \cdot AB \cdot \cos\alpha$. - **Travail du poids:** $W(\vec{P}) = mg(z_A - z_B)$. - **Puissance d'une force:** $P = \frac{dW}{dt} = \vec{F} \cdot \vec{v}$. - **Application:** Calcul de l'énergie dépensée, performance des moteurs. #### 4. Mouvement des Satellites et Planètes (Lois de Kepler) - **Loi des orbites:** Les planètes décrivent des ellipses dont le Soleil occupe l'un des foyers. (Pour les satellites, la Terre est au foyer). - **Loi des aires:** Le segment reliant le Soleil à une planète balaie des aires égales pendant des durées égales. - **Loi des périodes:** Le rapport du carré de la période de révolution $T$ au cube du demi-grand axe $a$ de l'orbite est constant pour tous les corps en orbite autour du même astre central: $\frac{T^2}{a^3} = \text{constante} = \frac{4\pi^2}{GM}$. (Pour orbites circulaires, $a=r$). - **Force de gravitation universelle:** $F = G \frac{m_1 m_2}{r^2}$. - **Vitesse de satellisation:** Pour orbite circulaire, $v = \sqrt{\frac{GM}{r}}$. - **Application:** Orbites des satellites, géostationnaire, exploration spatiale. ### Oscillations Mécaniques #### 1. Pendule Simple - **Période propre:** $T_0 = 2\pi \sqrt{\frac{L}{g}}$ (pour petites oscillations, $\theta ### Ondes Mécaniques Périodiques #### 1. Généralités - **Définition:** Propagation d'une perturbation sans transport de matière, avec transport d'énergie. - **Types:** - **Transversales:** Direction de la perturbation perpendiculaire à la direction de propagation (corde, ondes à la surface de l'eau). - **Longitudinales:** Direction de la perturbation parallèle à la direction de propagation (son). - **Périodicité spatiale (longueur d'onde $\lambda$):** Distance parcourue par l'onde pendant une période $T$. - **Périodicité temporelle (période $T$, fréquence $f$):** $f = \frac{1}{T}$. - **Célérité (vitesse de propagation):** $v = \frac{\lambda}{T} = \lambda f$. - **Milieu dispersif:** La célérité dépend de la fréquence. - **Application:** Ultrasons (échographie), sismologie. #### 2. Ondes Sonores - **Nature:** Onde mécanique longitudinale. - **Domaine audible:** 20 Hz à 20 kHz. - **Intensité sonore ($I$):** $I = \frac{P}{S}$ (Puissance par unité de surface, en W/m$^2$). - **Niveau d'intensité sonore ($L$):** $L = 10 \log\left(\frac{I}{I_0}\right)$ en décibels (dB), avec $I_0 = 10^{-12} \text{ W/m}^2$ (seuil d'audibilité). - **Application:** Acoustique des salles, audiométrie, sonar. #### 3. Diffraction et Interférences - **Diffraction:** Déviation des ondes lorsqu'elles rencontrent un obstacle ou une ouverture de taille comparable à la longueur d'onde. - **Condition:** Dimension de l'obstacle/ouverture ($a$) comparable à $\lambda$. - **Écart angulaire de diffraction:** $\theta \approx \frac{\lambda}{a}$ (pour fente fine). - **Interférences:** Superposition de deux ondes cohérentes (même fréquence, déphasage constant), créant des zones de renforcement (interférences constructives) et d'affaiblissement (interférences destructives). - **Condition:** Deux sources cohérentes. - **Application:** Holographie, microscopie optique (limite de résolution), filtres interférentiels. ### Propagation de la Lumière et Ondes Lumineuses #### 1. Aspects Ondulatoires de la Lumière - La lumière est une onde électromagnétique. - **Célérité de la lumière dans le vide:** $c = 3 \times 10^8 \text{ m/s}$. - **Relation fondamentale:** $c = \lambda_{vide} f$. - **Indice de réfraction:** $n = \frac{c}{v}$ (où $v$ est la célérité dans le milieu). $\lambda_{milieu} = \frac{\lambda_{vide}}{n}$. #### 2. Diffraction de la Lumière - Même phénomène que pour les ondes mécaniques, mais avec la lumière. - **Diffraction par une fente:** Tâche centrale large et brillante, entourée de tâches secondaires moins intenses. - **Largeur angulaire de la tâche centrale:** $2\theta = 2\frac{\lambda}{a}$ (pour petits angles). - **Largeur linéaire de la tâche centrale sur un écran:** $L = 2D\theta = 2D\frac{\lambda}{a}$ (où $D$ est la distance fente-écran). - **Application:** Détermination de la longueur d'onde, limite de résolution des instruments optiques. #### 3. Interférences Lumineuses (Fentes de Young) - Deux sources de lumière cohérentes (obtenues à partir d'une seule source par division du front d'onde). - **Franges d'interférence:** Alternance de franges brillantes (constructives) et sombres (destructives). - **Interfrange ($i$):** Distance entre deux franges brillantes (ou sombres) consécutives. $i = \frac{\lambda D}{b}$ (où $b$ est la distance entre les fentes, $D$ la distance fentes-écran). - **Application:** Mesure de longueurs d'onde, interféromètres. ### Transformations Nucléaires #### 1. Radioactivité - **Définition:** Désintégration spontanée de noyaux atomiques instables (radio-isotopes) en noyaux plus stables, en émettant des particules (alpha $\alpha$, bêta moins $\beta^-$, bêta plus $\beta^+$) et/ou des rayonnements électromagnétiques (gamma $\gamma$). - **Lois de Soddy (lois de conservation):** - Conservation du nombre de masse $A$ (nombre de nucléons). - Conservation du nombre de charge $Z$ (nombre de protons). - **Exemples de désintégrations:** - **Alpha ($\alpha$):** Émission d'un noyau d'hélium (${}^{4}_{2}He$). ${}^{A}_{Z}X \to {}^{A-4}_{Z-2}Y + {}^{4}_{2}He$. - **Bêta moins ($\beta^-$):** Transformation d'un neutron en proton et émission d'un électron (${}^{0}_{-1}e$). ${}^{A}_{Z}X \to {}^{A}_{Z+1}Y + {}^{0}_{-1}e$. - **Bêta plus ($\beta^+$):** Transformation d'un proton en neutron et émission d'un positon (${}^{0}_{+1}e$). ${}^{A}_{Z}X \to {}^{A}_{Z-1}Y + {}^{0}_{+1}e$. - **Loi de décroissance radioactive:** $N(t) = N_0 e^{-\lambda t}$, où $N(t)$ est le nombre de noyaux restants à l'instant $t$, $N_0$ le nombre initial, et $\lambda$ la constante radioactive. - **Période radioactive (demi-vie $T_{1/2}$):** Temps nécessaire pour que la moitié des noyaux initialement présents se désintègrent. $T_{1/2} = \frac{\ln 2}{\lambda}$. - **Activité ($A(t)$):** Nombre de désintégrations par seconde. $A(t) = \lambda N(t)$. Unité: Becquerel (Bq). - **Application:** Datation (carbone 14, uranium), imagerie médicale (TEP), production d'énergie, stérilisation. #### 2. Fission et Fusion Nucléaires - **Fission:** Réaction nucléaire provoquée au cours de laquelle un noyau lourd (ex: uranium-235) se scinde en plusieurs noyaux plus légers sous l'impact d'un neutron, libérant une grande quantité d'énergie et plusieurs neutrons. - **Réaction en chaîne:** Les neutrons libérés peuvent provoquer la fission d'autres noyaux. - **Application:** Centrales nucléaires (énergie électrique), bombe atomique. - **Fusion:** Réaction nucléaire où deux noyaux légers s'unissent pour former un noyau plus lourd, libérant une énergie colossale (plus que la fission). - **Exemple:** Fusion de deutérium et tritium pour former de l'hélium. - **Application:** Réactions au sein des étoiles (Soleil), recherche sur l'énergie propre (ITER). #### 3. Bilan de Masse et Énergie - **Défaut de masse ($\Delta m$):** Différence entre la masse des nucléons isolés et la masse du noyau qu'ils forment. $\Delta m = (Z m_p + (A-Z) m_n) - m_{noyau}$. - **Énergie de liaison ($E_L$):** Énergie nécessaire pour séparer un noyau en ses nucléons. $E_L = \Delta m c^2$. - **Énergie de liaison par nucléon:** $E_L/A$. Plus elle est grande, plus le noyau est stable. - **Équivalence masse-énergie (Einstein):** $E = mc^2$. Toute variation de masse $\Delta m$ correspond à une variation d'énergie $\Delta E = \Delta m c^2$. - **Application:** Calcul de l'énergie libérée lors des réactions nucléaires (fission, fusion, radioactivité). ### Électricité : Courant Alternatif Sinusoïdal #### 1. Caractéristiques d'une Tension ou d'un Courant Sinusoïdal - **Expression temporelle:** - Tension: $u(t) = U_{max} \cos(\omega t + \phi_u)$ - Courant: $i(t) = I_{max} \cos(\omega t + \phi_i)$ - **Valeurs maximales:** $U_{max}$, $I_{max}$. - **Période ($T$):** Durée d'un cycle (en s). - **Fréquence ($f$):** Nombre de cycles par seconde (en Hz). $f = \frac{1}{T}$. - **Pulsation ($\omega$):** $\omega = 2\pi f = \frac{2\pi}{T}$ (en rad/s). - **Phase à l'origine:** $\phi_u$, $\phi_i$. - **Valeurs efficaces:** Mesurées par les appareils (voltmètre, ampèremètre). - $U = \frac{U_{max}}{\sqrt{2}}$ - $I = \frac{I_{max}}{\sqrt{2}}$ - **Déphasage:** $\Delta \phi = \phi_u - \phi_i$. Indique le décalage temporel entre la tension et le courant. - **Application:** Analyse des réseaux électriques, dimensionnement des composants. #### 2. Dipôles Passifs en Régime Sinusoïdal Forcé - **Résistance ($R$):** - Loi d'Ohm: $u_R(t) = R i(t)$. - $U_R = R I$. - Le courant et la tension sont en phase ($\Delta \phi = 0$). - **Bobine pure (Inductance $L$):** - $u_L(t) = L \frac{di}{dt}$. - $U_L = L\omega I = X_L I$, où $X_L$ est la réactance inductive. - La tension $u_L$ est en avance de phase de $\frac{\pi}{2}$ sur le courant $i$. - **Condensateur pur (Capacité $C$):** - $i(t) = C \frac{du_C}{dt}$. - $U_C = \frac{1}{C\omega} I = X_C I$, où $X_C$ est la réactance capacitive. - La tension $u_C$ est en retard de phase de $\frac{\pi}{2}$ sur le courant $i$. - **Application:** Filtrage des signaux, adaptation d'impédance. #### 3. Circuit RLC Série - **Impédance ($Z$):** Résistance totale du circuit au courant alternatif. - $Z = \sqrt{R^2 + (L\omega - \frac{1}{C\omega})^2}$. - $U = Z I$. - **Déphasage du circuit:** $\tan(\Delta \phi) = \frac{L\omega - \frac{1}{C\omega}}{R}$. - **Résonance en intensité:** Se produit lorsque $L\omega = \frac{1}{C\omega}$, c'est-à-dire $X_L = X_C$. - Fréquence de résonance: $f_0 = \frac{1}{2\pi\sqrt{LC}}$. - À la résonance: $Z=R$ (minimum), $I$ est maximal, $\Delta \phi = 0$ (tension et courant en phase). - **Facteur de qualité ($Q$):** Caractérise la sélectivité du circuit. - $Q = \frac{L\omega_0}{R} = \frac{1}{R} \sqrt{\frac{L}{C}}$. - **Application:** Circuits d'accord (radio, TV), filtres sélectifs (passe-bande). #### 4. Puissance en Courant Alternatif - **Puissance instantanée:** $p(t) = u(t) i(t)$. - **Puissance moyenne (active) ($P$):** Puissance réellement consommée par le circuit. - $P = U I \cos(\Delta \phi)$. Unité: Watt (W). - Le terme $\cos(\Delta \phi)$ est appelé facteur de puissance. - **Puissance apparente ($S$):** $S = U I$. Unité: Volt-Ampère (VA). - **Puissance réactive ($Q_r$):** Énergie échangée sans être consommée. $Q_r = U I \sin(\Delta \phi)$. Unité: Volt-Ampère Réactif (VAR). - **Application:** Compensation de l'énergie réactive pour optimiser la consommation électrique (facturation). ### Transformations Chimiques Lentes et Rapides #### 1. Vitesse de Réaction et Facteurs Cinétiques - **Vitesse de réaction:** Mesure la rapidité avec laquelle les réactifs sont consommés ou les produits formés. Elle est définie par la variation de la concentration d'un réactif ou d'un produit par unité de temps. - Pour $aA + bB \to cC + dD$: $v = -\frac{1}{a}\frac{d[A]}{dt} = -\frac{1}{b}\frac{d[B]}{dt} = \frac{1}{c}\frac{d[C]}{dt} = \frac{1}{d}\frac{d[D]}{dt}$. - **Facteurs cinétiques:** Paramètres qui influencent la vitesse d'une réaction chimique. - **Température:** Augmente la vitesse (augmente l'agitation moléculaire et la fréquence des chocs efficaces). - **Concentration des réactifs:** Augmente la vitesse (augmente la probabilité de chocs entre réactifs). - **Catalyseur:** Substance qui augmente la vitesse d'une réaction sans être consommée et sans modifier l'état final du système. - **Surface de contact:** Pour les réactifs solides, une plus grande surface de contact augmente la vitesse. - **Temps de demi-réaction ($t_{1/2}$):** Temps nécessaire pour que la concentration d'un réactif limitant soit réduite de moitié par rapport à sa valeur initiale. - **Application:** Optimisation des processus industriels, contrôle des réactions (ex: cuisson). #### 2. Suivi Temporel d'une Transformation Chimique - **But:** Déterminer l'évolution de la concentration des espèces en fonction du temps pour en déduire la vitesse de réaction. - **Méthodes de suivi:** - **Conductimétrie:** Mesure de la conductivité de la solution si des ions sont consommés ou produits. - **pH-métrie:** Mesure du pH si des ions $H_3O^+$ ou $OH^-$ sont consommés ou produits. - **Spectrophotométrie:** Mesure de l'absorbance de la solution si une espèce colorée est consommée ou produite. - **Titrage (dosage):** Prélèvement d'échantillons à différents instants, puis dosage rapide d'une espèce pour déterminer sa concentration. - **Mesure de pression ou de volume:** Si des gaz sont impliqués. - **Application:** Étude des mécanismes réactionnels, contrôle qualité. ### États d'Équilibre et Groupes Fonctionnels #### 1. Transformations Chimiques : État Initial, État Final, Taux d'Avancement - **Avancement de la réaction ($x$):** Quantité de matière de produit formé ou de réactif consommé (en mol). - **Taux d'avancement final ($\tau$):** $\tau = \frac{x_{final}}{x_{max}}$. - Si $\tau = 1$, la réaction est totale. - Si $\tau 7$: basique (à 25°C). - **Constante d'acidité ($K_a$):** Pour le couple $AH/A^-$, $K_a = \frac{[A^-]_{eq}[H_3O^+]_{eq}}{[AH]_{eq}}$. - $pK_a = -\log K_a$. - Plus le $K_a$ est grand (ou $pK_a$ petit), plus l'acide est fort. - **Domaine de prédominance:** Pour un couple $AH/A^-$, - Si $pH pK_a$, $A^-$ prédomine. - Si $pH = pK_a$, $[AH] = [A^-]$. - **Application:** Titrages acido-basiques, solutions tampons (régulation du pH, ex: sang), chimie analytique. #### 3. Titrage Acido-Basique - **But:** Déterminer la concentration inconnue d'une solution acide ou basique. - **Principe:** Réaction acido-basique totale et rapide entre l'espèce à titrer et une solution titrante de concentration connue. - **Point d'équivalence:** Point où les réactifs ont été introduits dans les proportions stœchiométriques. - **Relation à l'équivalence:** $n_{acide \ titré} = n_{base \ titrante}$ (ou vice-versa), soit $C_A V_A = C_B V_B$ (si 1:1). - **Détection de l'équivalence:** - **pH-métrie:** Courbe de titrage (pH en fonction du volume de titrant ajouté), l'équivalence est le point d'inflexion. - **Indicateurs colorés:** Changent de couleur dans une zone de pH qui doit contenir le pH à l'équivalence. - **Application:** Contrôle qualité dans l'industrie alimentaire, pharmaceutique, analyse environnementale. #### 4. Groupes Fonctionnels en Chimie Organique - **Définition:** Atome ou groupe d'atomes qui confère des propriétés chimiques spécifiques à une molécule organique. - **Principaux groupes fonctionnels:** - **Alcanes:** R-H (liaisons simples C-C), exemple: méthane, éthane. - **Alcènes:** R-CH=CH-R' (double liaison C=C), exemple: éthène. - **Alcynes:** R-C≡C-R' (triple liaison C≡C), exemple: éthyne. - **Halogénoalcanes:** R-X (X = F, Cl, Br, I), exemple: chloroéthane. - **Alcools:** R-OH (groupe hydroxyle), exemple: éthanol. - **Aldéhydes:** R-CHO (groupe carbonyle en bout de chaîne), exemple: éthanal. - **Cétones:** R-CO-R' (groupe carbonyle en milieu de chaîne), exemple: propanone. - **Acides Carboxyliques:** R-COOH (groupe carboxyle), exemple: acide éthanoïque. - **Esters:** R-COO-R' (groupe ester), exemple: éthanoate d'éthyle. - **Amines:** R-$NH_2$, R-$NHR'$, R-$NR'R''$ (groupe amine), exemple: méthylamine. - **Amides:** R-CO-$NH_2$ (groupe amide). - **Application:** Comprendre la réactivité des molécules, la synthèse de nouvelles substances (médicaments, polymères, parfums). ### Réactions en Chimie Organique #### 1. Oxydoréduction en Chimie Organique - **Définition:** Perte d'électrons (oxydation) ou gain d'électrons (réduction). En chimie organique, cela se traduit souvent par une augmentation ou diminution des liaisons C-O, C-N ou C-X (halogène), et une diminution ou augmentation des liaisons C-H. - **Oxydation des alcools:** - **Alcool primaire ($R-CH_2OH$):** - Oxydation ménagée (agent oxydant doux, chauffé): $\to$ Aldéhyde ($R-CHO$). - Oxydation forte (agent oxydant fort, chauffé à reflux): $\to$ Acide Carboxylique ($R-COOH$). - **Alcool secondaire ($R-CHOH-R'$):** - Oxydation (quel que soit l'oxydant): $\to$ Cétone ($R-CO-R'$). - **Alcool tertiaire ($R-COH(R')(R'')$):** Résistant à l'oxydation sans rupture de la chaîne carbonée. - **Application:** Synthèse de produits chimiques (solvants, intermédiaires de synthèse). #### 2. Réactions d'Estérification et d'Hydrolyse - **Estérification:** Réaction entre un acide carboxylique et un alcool pour former un ester et de l'eau. - $R-COOH + R'-OH \rightleftharpoons R-COO-R' + H_2O$. - **Caractéristiques:** Lente, limitée (réaction à l'équilibre), athermique (ne dégage pas de chaleur). - **Amélioration du rendement:** Utilisation d'un excès de l'un des réactifs ou élimination continue de l'eau. - **Hydrolyse:** Réaction inverse de l'estérification, l'ester réagit avec l'eau pour former un acide carboxylique et un alcool. - **Hydrolyse acide:** Catalysée par un acide fort ($H_2SO_4$), équilibrée. - **Hydrolyse basique (Saponification):** Réaction de l'ester avec une base forte (ex: $NaOH$). - $R-COO-R' + NaOH \to R-COO^-Na^+ + R'-OH$. - **Caractéristiques:** Totale, rapide. - **Produits:** Sel de l'acide carboxylique (savon) et alcool. - **Application:** Fabrication de savons, arômes alimentaires, solvants, produits pharmaceutiques. #### 3. Polymérisation - **Définition:** Processus par lequel de petites molécules (monomères) réagissent entre elles pour former de très longues chaînes (polymères). - **Types de polymérisation:** - **Polymérisation par addition:** Les monomères s'ajoutent les uns aux autres sans élimination de petites molécules. Nécessite souvent des monomères insaturés (ayant des doubles ou triples liaisons). - **Exemple:** Polymérisation de l'éthène pour former le polyéthylène. - **Polymérisation par condensation:** Les monomères réagissent en éliminant une petite molécule (ex: eau, $HCl$). - **Exemple:** Formation du nylon (polyamide) ou du PET (polyester). - **Application:** Fabrication de matières plastiques (emballages, jouets, pièces automobiles), fibres textiles, caoutchoucs, adhésifs. ### Contrôle de Qualité en Chimie #### 1. Titrages Directs et Indirects - **Titrages directs:** L'espèce à doser réagit directement avec le réactif titrant. - **Exemples:** Titrage acido-basique, titrage d'oxydoréduction, titrage par précipitation. - **Titrages indirects (par retour):** L'espèce à doser réagit avec un excès connu d'un réactif. L'excès de ce réactif est ensuite dosé par un deuxième réactif titrant. - **Application:** Détermination de la concentration d'une espèce dans un échantillon (produits pharmaceutiques, aliments, eaux). #### 2. La Chromographie - **Définition:** Famille de techniques de séparation basées sur la différence d'affinité des composants d'un mélange pour deux phases : une phase stationnaire (fixe) et une phase mobile (qui se déplace). - **Types courants:** - **Chromatographie sur couche mince (CCM):** Phase stationnaire solide (ex: silice), phase mobile liquide. Utilisée pour identifier des composés, suivre l'avancement d'une réaction. - **Chromatographie en phase gazeuse (CPG):** Phase stationnaire liquide (sur support solide), phase mobile gazeuse. Utilisée pour séparer et analyser des mélanges de composés volatils. - **Chromatographie liquide haute performance (HPLC):** Phase stationnaire solide, phase mobile liquide sous haute pression. Utilisée pour séparer et quantifier des composés dans des mélanges complexes. - **Application:** Analyse de pureté, identification de substances (dopage, aliments, médicaments), séparation de mélanges.