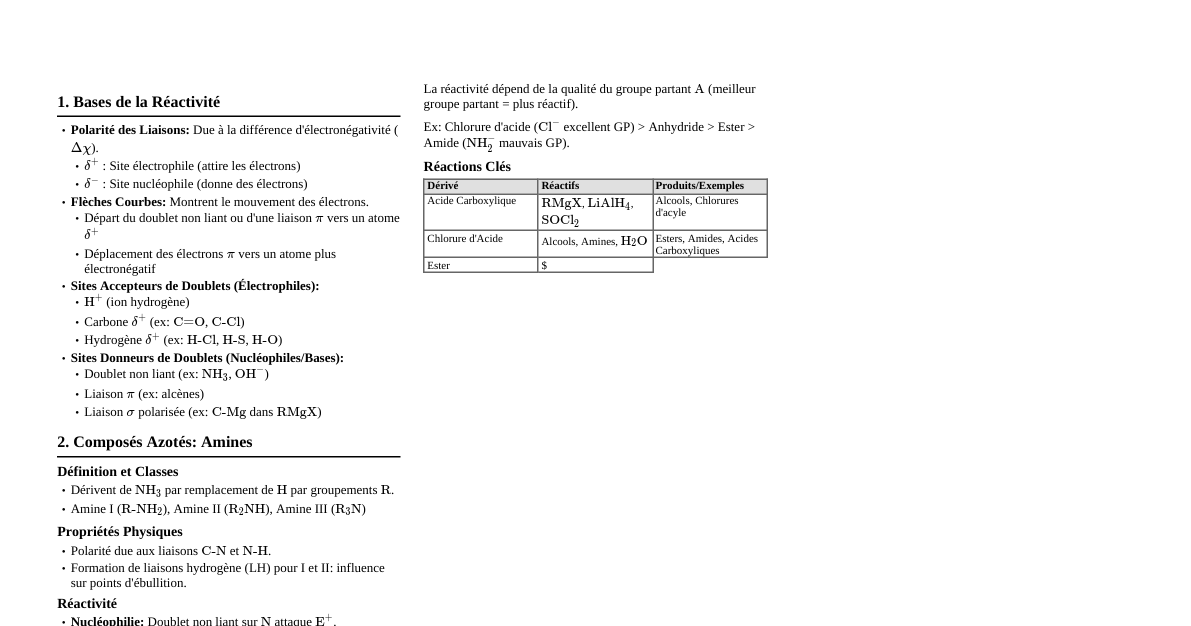
1. Définition et Branches de la Chimie La Chimie est la science qui étudie la matière, ses propriétés, sa composition, sa structure, et les transformations qu'elle subit. Chimie Organique: Étudie les composés du carbone (sauf quelques exceptions comme le CO, $CO_2$, les carbonates). Chimie Inorganique: Étudie tous les éléments et composés non organiques. Chimie Physique: Applique les principes de la physique à l'étude des systèmes chimiques (thermodynamique, cinétique, mécanique quantique). Chimie Analytique: Identifie et quantifie les substances chimiques dans des échantillons. Biochimie: Étudie les processus chimiques dans les organismes vivants. 2. La Matière Matière: Tout ce qui a une masse et occupe un volume. Substance Pure: Matière avec une composition et des propriétés uniformes et définies. Élément: Substance pure qui ne peut pas être décomposée en substances plus simples par des moyens chimiques (ex: O, H, Fe). Composé: Substance pure formée de deux ou plusieurs éléments chimiquement liés dans des proportions fixes (ex: $H_2O$, $NaCl$). Mélange: Combinaison physique de deux ou plusieurs substances pures. Mélange Homogène (Solution): Composition uniforme (ex: eau salée, air). Mélange Hétérogène: Composition non uniforme, on peut distinguer les composants (ex: sable et eau, salade). 3. Atomes et Molécules Atome: La plus petite unité d'un élément qui conserve les propriétés de cet élément. Composé d'un noyau (protons et neutrons) et d' électrons en orbite. Numéro Atomique (Z): Nombre de protons dans le noyau. Définit l'élément. Nombre de Masse (A): Nombre de protons + neutrons. Isotopes: Atomes du même élément (même Z) mais avec un nombre de neutrons différent (donc A différent). Molécule: Deux ou plusieurs atomes liés chimiquement. Peut être un élément ($O_2$) ou un composé ($H_2O$). Ion: Atome ou molécule ayant gagné ou perdu un ou plusieurs électrons, portant ainsi une charge électrique. Cation: Ion positif (perte d'électrons). Anion: Ion négatif (gain d'électrons). 4. Tableau Périodique des Éléments Organise les éléments par ordre croissant de numéro atomique (Z). Périodes (Lignes): Indiquent le nombre de couches électroniques principales. Groupes (Colonnes): Indiquent le nombre d'électrons de valence et déterminent les propriétés chimiques similaires. Métaux Alcalins (Groupe 1): Très réactifs. Métaux Alcalino-Terreux (Groupe 2): Réactifs. Halogènes (Groupe 17): Très réactifs, forment des sels. Gaz Nobles (Groupe 18): Très peu réactifs (stables). Tendances Périodiques: Rayon Atomique: Diminue de gauche à droite, augmente de haut en bas. Énergie d'Ionisation: Augmente de gauche à droite, diminue de haut en bas. Électronégativité: Augmente de gauche à droite, diminue de haut en bas. 5. Liaisons Chimiques Les atomes se lient pour atteindre une configuration électronique plus stable (souvent un octet d'électrons de valence). Liaison Ionique: Transfert d'électrons entre un métal et un non-métal, formant des ions qui s'attirent (ex: $NaCl$). Liaison Covalente: Partage d'électrons entre deux non-métaux. Liaison Covalente Pure (Non Polaire): Partage égal d'électrons (ex: $O_2$). Liaison Covalente Polaire: Partage inégal d'électrons dû à une différence d'électronégativité, créant des charges partielles (ex: $H_2O$). Liaison Métallique: Nuage d'électrons délocalisés partagé entre de nombreux noyaux métalliques. 6. Réactions Chimiques Processus par lequel une ou plusieurs substances (réactifs) sont converties en substances différentes (produits). Représentées par des équations chimiques (ex: $2H_2 + O_2 \rightarrow 2H_2O$). Loi de Conservation de la Masse: La masse totale des réactifs est égale à la masse totale des produits. Les équations doivent être équilibrées. Types de Réactions: Synthèse (Combinaison): $A + B \rightarrow AB$ Décomposition: $AB \rightarrow A + B$ Simple Déplacement: $A + BC \rightarrow AC + B$ Double Déplacement: $AB + CD \rightarrow AD + CB$ Combustion: Réaction avec l'oxygène, souvent produisant de la chaleur et de la lumière. Acido-Basique: Transfert de protons ($H^+$) (Brønsted-Lowry) ou d'électrons (Lewis). 7. Stoechiométrie L'étude quantitative des réactifs et produits dans les réactions chimiques. Mole (mol): Unité de quantité de matière. Contient le nombre d'Avogadro ($N_A = 6.022 \times 10^{23}$) d'entités (atomes, molécules, ions). Masse Molaire (M): Masse d'une mole d'une substance (g/mol). Numériquement égale à la masse atomique/moléculaire en uma. Calculs Stoechiométriques: Utilisent les ratios molaires des équations équilibrées pour convertir entre masse, moles ou volume de réactifs et produits. 8. États de la Matière Solide: Forme et volume définis. Particules étroitement liées et vibrantes. Liquide: Volume défini, prend la forme du contenant. Particules proches mais mobiles. Gaz: Pas de forme ni de volume définis, remplit tout le volume disponible. Particules très éloignées et en mouvement rapide. Plasma: Gaz ionisé, présent dans les étoiles et les décharges électriques. Transitions de Phase: Fusion (solide $\rightarrow$ liquide) Vaporisation (liquide $\rightarrow$ gaz) Condensation (gaz $\rightarrow$ liquide) Solidification (liquide $\rightarrow$ solide) Sublimation (solide $\rightarrow$ gaz) Déposition (gaz $\rightarrow$ solide)