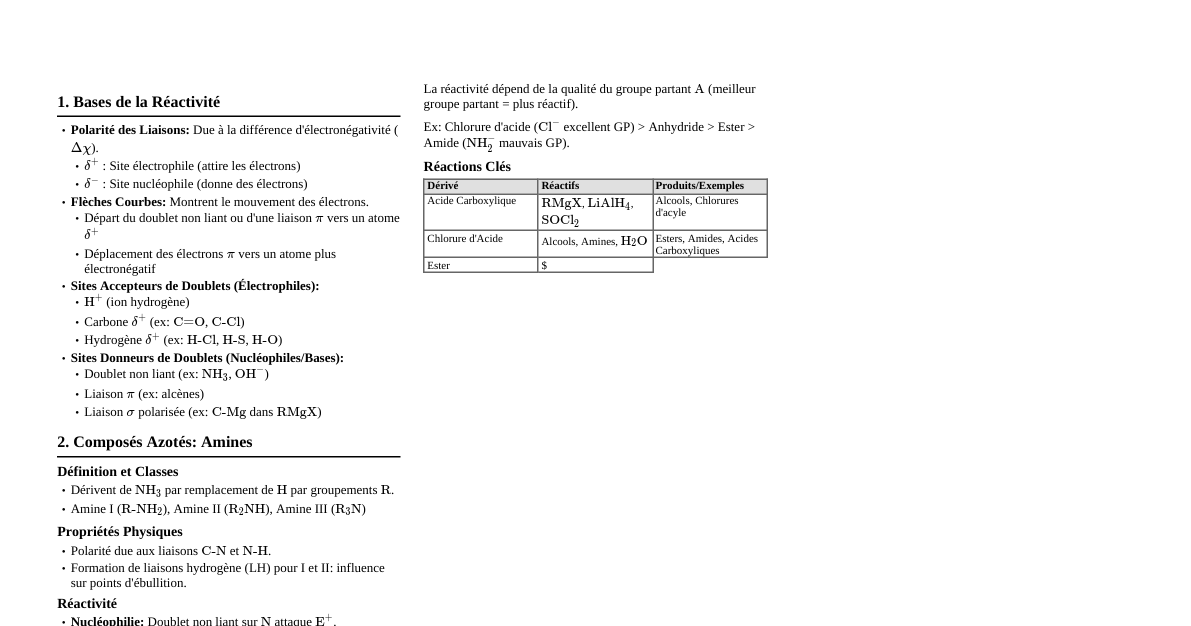
Constantes Fondamentales Constante de Planck: $h = 6.624 \times 10^{-34} \text{ J} \cdot \text{s}$ Masse de l'électron: $m_e = 9.11 \times 10^{-31} \text{ kg}$ Charge élémentaire: $e = 1.602 \times 10^{-19} \text{ C}$ Vitesse de la lumière: $c = 3.108 \times 10^8 \text{ m} \cdot \text{s}^{-1}$ Constante de Rydberg: $R_H = 109677.76 \text{ cm}^{-1}$ Énergie d'un électron (atome polyélectronique): $E_n = -13.6 \frac{Z^{*2}}{n^2} \text{ (eV)}$ Exercice 1: Structure Atomique 1. Nombres Quantiques du Gallium (Ga, Z=31) Configuration électronique du Ga (Z=31): $1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^{10} 4p^1$. L'électron célibataire est dans l'orbitale $4p^1$. Nombre quantique principal $n$: $4$ Nombre quantique azimutal $l$: pour une orbitale p, $l=1$ Nombre quantique magnétique $m_l$: peut être $-1, 0, 1$. On peut choisir $m_l = 0$ par convention pour l'électron célibataire. Nombre quantique de spin $m_s$: $\pm \frac{1}{2}$. On peut choisir $m_s = +\frac{1}{2}$. Les nombres quantiques sont donc $(4, 1, 0, +\frac{1}{2})$. 2. Atome X$^{2+}$ avec structure de l'Argon (Ar, Z=18) Si X$^{2+}$ a la configuration électronique de l'Argon (Z=18), cela signifie qu'il a 18 électrons. Puisque l'ion a perdu 2 électrons (X$^{2+}$), l'atome neutre X avait $18 + 2 = 20$ électrons. Le numéro atomique Z de l'atome X est donc $20$. Il s'agit du Calcium (Ca). 3. Élément avec 7 électrons 3d La configuration électronique se termine par $3d^7$. Configuration complète: $1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^7$. Le nombre total d'électrons est $2+2+6+2+6+2+7 = 27$. Le numéro atomique Z est $27$. Il s'agit du Cobalt (Co). Exercice 2: Atome de Lithium et Énergie 1. Hydrogénoïde Li$^{2+}$ (Z=3) L'énergie d'un électron dans un atome hydrogénoïde est donnée par $E_n = -13.6 \frac{Z^2}{n^2} \text{ eV}$. Pour Li$^{2+}$, $Z=3$. a- Énergie libérée lors de la transition $n=4 \to n=2$ $E_4 = -13.6 \frac{3^2}{4^2} = -13.6 \frac{9}{16} = -7.65 \text{ eV}$ $E_2 = -13.6 \frac{3^2}{2^2} = -13.6 \frac{9}{4} = -30.6 \text{ eV}$ Énergie libérée $\Delta E = E_4 - E_2 = -7.65 - (-30.6) = 22.95 \text{ eV}$ En Joules: $\Delta E = 22.95 \text{ eV} \times 1.602 \times 10^{-19} \text{ J/eV} = 3.676 \times 10^{-18} \text{ J}$ b- Longueur d'onde et série de la raie ($n=4 \to n=2$) On utilise la relation $\Delta E = h \frac{c}{\lambda}$. Donc $\lambda = \frac{hc}{\Delta E}$. $\lambda = \frac{6.624 \times 10^{-34} \text{ J} \cdot \text{s} \times 3.108 \times 10^8 \text{ m} \cdot \text{s}^{-1}}{3.676 \times 10^{-18} \text{ J}}$ $\lambda \approx 5.60 \times 10^{-8} \text{ m} = 56.0 \text{ nm}$ Puisque la transition aboutit au niveau $n=2$, il s'agit de la série de Balmer. Cette longueur d'onde ($56.0 \text{ nm}$) se situe dans le domaine de l'ultraviolet (UV). 2. Atome polyélectronique de Lithium (Li, Z=3) Configuration électronique du Li: $1s^2 2s^1$. L'électron périphérique est le $2s^1$. On utilise la formule $E_n = -13.6 \frac{Z^{*2}}{n^2} \text{ (eV)}$. Pour l'électron $2s^1$ du Lithium, $n=2$. Calcul de $Z^{*}$ (charge nucléaire effective) par la règle de Slater: Électrons dans le même groupe (ici, $2s^1$): $0.35 \times (\text{nombre d'électrons} - 1) = 0.35 \times (1-1) = 0$ Électrons dans le groupe $n-1 = 1$: $0.85 \times (\text{nombre d'électrons}) = 0.85 \times 2 = 1.7$ (pour les $1s^2$) Constante d'écran $\sigma = 0 + 1.7 = 1.7$ $Z^* = Z - \sigma = 3 - 1.7 = 1.3$ a- Énergie de l'électron périphérique $E_{2s} = -13.6 \frac{(1.3)^2}{2^2} = -13.6 \frac{1.69}{4} = -5.75 \text{ eV}$ b- Énergie d'ionisation de l'atome Li (gazeux) L'énergie d'ionisation est l'énergie nécessaire pour retirer l'électron le moins lié (l'électron périphérique) de l'atome à l'état gazeux. Elle est égale à l'opposé de l'énergie de cet électron. $E_{ionisation} = -E_{2s} = -(-5.75 \text{ eV}) = 5.75 \text{ eV}$ c- Énergie de l'atome Li (gazeux) L'énergie totale de l'atome de Lithium est la somme des énergies de ses électrons. Pour les $1s^2$ électrons: $n=1$. Calcul de $Z^{*}$ pour un électron $1s$ (règle de Slater): Électrons dans le même groupe ($1s^2$): $0.31 \times (\text{nombre d'électrons} - 1) = 0.31 \times (2-1) = 0.31$ $\sigma_{1s} = 0.31$ $Z^*_{1s} = Z - \sigma_{1s} = 3 - 0.31 = 2.69$ Énergie d'un électron $1s$: $E_{1s} = -13.6 \frac{(2.69)^2}{1^2} = -13.6 \times 7.2361 = -98.39 \text{ eV}$ L'énergie totale de l'atome Li est $2 \times E_{1s} + E_{2s} = 2 \times (-98.39 \text{ eV}) + (-5.75 \text{ eV})$ $E_{totale} = -196.78 - 5.75 = -202.53 \text{ eV}$ Exercice 3: Atome d'Hydrogène L'énergie des niveaux pour l'Hydrogène ($Z=1$) est $E_n = -13.6/n^2 \text{ eV}$. 1. Absorption de 10.2 eV depuis l'état fondamental ($n=1$) $E_1 = -13.6/1^2 = -13.6 \text{ eV}$ Après absorption, l'énergie finale $E_f = E_1 + 10.2 \text{ eV} = -13.6 + 10.2 = -3.4 \text{ eV}$ On cherche $n$ tel que $E_n = -13.6/n^2 = -3.4 \text{ eV}$ $n^2 = -13.6 / -3.4 = 4$ Donc, $n=2$. L'électron se trouve au niveau $n=2$. 2. Émission de radiation de $\lambda = 1027 \text{ Å}$ depuis $n=3$ Convertir $\lambda$ en mètres: $1027 \text{ Å} = 1027 \times 10^{-10} \text{ m} = 1.027 \times 10^{-7} \text{ m}$ Énergie du photon émis: $\Delta E = \frac{hc}{\lambda}$ $\Delta E = \frac{6.624 \times 10^{-34} \text{ J} \cdot \text{s} \times 3.108 \times 10^8 \text{ m} \cdot \text{s}^{-1}}{1.027 \times 10^{-7} \text{ m}} = 2.00 \times 10^{-18} \text{ J}$ En eV: $\Delta E = \frac{2.00 \times 10^{-18} \text{ J}}{1.602 \times 10^{-19} \text{ J/eV}} = 12.48 \text{ eV}$ $E_3 = -13.6/3^2 = -13.6/9 = -1.51 \text{ eV}$ Puisqu'il y a émission, l'énergie finale $E_f = E_3 - \Delta E = -1.51 - 12.48 = -13.99 \text{ eV}$ Cela semble être une erreur de calcul ou une donnée imprécise, car l'énergie ne peut pas être inférieure à $E_1$. Vérifions en utilisant l'équation de Rydberg: $\frac{1}{\lambda} = R_H Z^2 (\frac{1}{n_f^2} - \frac{1}{n_i^2})$ Pour l'Hydrogène ($Z=1$), $n_i=3$. $\frac{1}{1.027 \times 10^{-7} \text{ m}} = 109677.76 \times 10^2 \text{ m}^{-1} (\frac{1}{n_f^2} - \frac{1}{3^2})$ $9.737 \times 10^6 \text{ m}^{-1} = 10967776 \text{ m}^{-1} (\frac{1}{n_f^2} - \frac{1}{9})$ $0.887 = \frac{1}{n_f^2} - \frac{1}{9}$ $\frac{1}{n_f^2} = 0.887 + \frac{1}{9} = 0.887 + 0.111 = 0.998 \approx 1$ $n_f^2 \approx 1$, donc $n_f=1$. L'électron se retrouve au niveau $n=1$ (état fondamental). 3. Absorption d'un photon pour passer de $n=2$ à $n=4$ $\Delta E = E_4 - E_2$ $E_4 = -13.6/4^2 = -13.6/16 = -0.85 \text{ eV}$ $E_2 = -13.6/2^2 = -13.6/4 = -3.4 \text{ eV}$ $\Delta E = -0.85 - (-3.4) = 2.55 \text{ eV}$ Calcul de la longueur d'onde $\lambda = \frac{hc}{\Delta E}$ $\Delta E = 2.55 \text{ eV} \times 1.602 \times 10^{-19} \text{ J/eV} = 4.085 \times 10^{-19} \text{ J}$ $\lambda = \frac{6.624 \times 10^{-34} \text{ J} \cdot \text{s} \times 3.108 \times 10^8 \text{ m} \cdot \text{s}^{-1}}{4.085 \times 10^{-19} \text{ J}}$ $\lambda \approx 5.04 \times 10^{-7} \text{ m} = 504 \text{ nm}$ Exercice 4: Thermochimie - Combustion de l'Éthane ($C_2H_6$) Réaction de combustion de l'éthane: $C_2H_6 (g) + \frac{7}{2} O_2 (g) \to 2CO_2 (g) + 3H_2O (l)$ avec $\Delta H_r°_{298} (1) = -373.8 \text{ kcal}$ Réactions de formation données: $(2) \quad C (graphite) + O_2 (g) \to CO_2 (g)$ avec $\Delta H_r°_{298} (2) = -94.05 \text{ kcal}$ $(3) \quad H_2 (g) + \frac{1}{2}O_2 (g) \to H_2O (l)$ avec $\Delta H_r°_{298} (3) = -68.3 \text{ kcal}$ Calcul de l'enthalpie molaire standard de formation de l'éthane ($\Delta H_f°_{298} (C_2H_6, g)$) L'enthalpie de réaction peut être calculée à partir des enthalpies de formation des produits et des réactifs: $\Delta H_r° = \sum \nu_p \Delta H_f° (produits) - \sum \nu_r \Delta H_f° (réactifs)$ Pour la réaction (1): $\Delta H_r° (1) = [2 \Delta H_f° (CO_2, g) + 3 \Delta H_f° (H_2O, l)] - [\Delta H_f° (C_2H_6, g) + \frac{7}{2} \Delta H_f° (O_2, g)] $ On sait que $\Delta H_f° (O_2, g) = 0$ (corps pur à l'état standard). Les enthalpies de réaction (2) et (3) sont en fait les enthalpies de formation de $CO_2 (g)$ et $H_2O (l)$ respectivement, puisque les réactifs sont des corps purs à l'état standard. $\Delta H_f° (CO_2, g) = -94.05 \text{ kcal}$ $\Delta H_f° (H_2O, l) = -68.3 \text{ kcal}$ Substituons les valeurs dans l'équation de la réaction (1): $-373.8 = [2 \times (-94.05) + 3 \times (-68.3)] - [\Delta H_f° (C_2H_6, g) + \frac{7}{2} \times 0]$ $-373.8 = [-188.1 - 204.9] - \Delta H_f° (C_2H_6, g)$ $-373.8 = -393.0 - \Delta H_f° (C_2H_6, g)$ $\Delta H_f° (C_2H_6, g) = -393.0 + 373.8$ $\Delta H_f° (C_2H_6, g) = -19.2 \text{ kcal}$