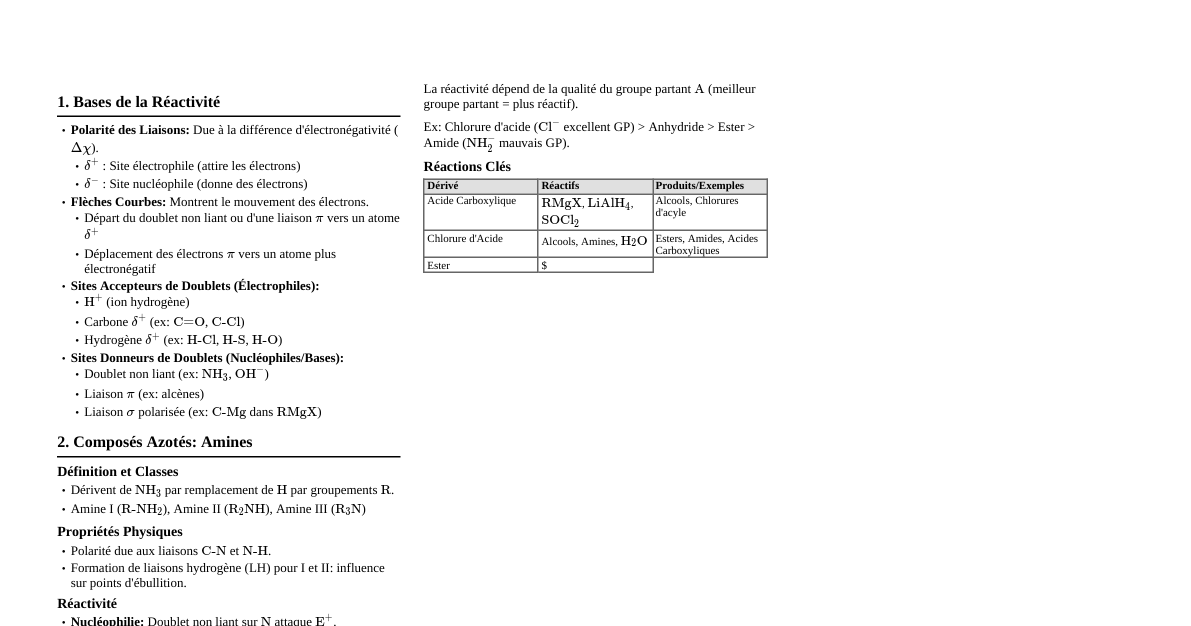
Nomenclature des Alcanes Préfixes: 1: Méth- 2: Éth- 3: Prop- 4: But- 5: Pent- 6: Hex- 7: Hept- 8: Oct- 9: Non- 10: Déc- Sufixe: -ane Exemple: $CH_4$ (Méthane), $C_2H_6$ (Éthane) Groupes Alkyles: R-yl (Méthyl, Éthyl, Propyl) Nomenclature des Alcènes et Alcynes Alcènes: Au moins une double liaison C=C. Suffixe -ène. Position de la double liaison indiquée par le plus petit chiffre. Ex: But-1-ène, But-2-ène Alcynes: Au moins une triple liaison C$\equiv$C. Suffixe -yne. Position de la triple liaison indiquée. Ex: Propyne, But-1-yne Groupes Fonctionnels Communs Classe Formule Générale Suffixe/Préfixe Exemple Alcool R-OH -ol / Hydroxy- Éthanol ($CH_3CH_2OH$) Éther R-O-R' -éther / Oxy- Diéthyl éther ($CH_3CH_2OCH_2CH_3$) Aldéhyde R-CHO -al / Formyl- Éthanal ($CH_3CHO$) Cétone R-CO-R' -one / Oxo- Propanone ($CH_3COCH_3$) Acide Carboxylique R-COOH Acide -oïque / Carboxy- Acide Éthanoïque ($CH_3COOH$) Ester R-COO-R' -oate de -yle Éthanoate d'éthyle ($CH_3COOCH_2CH_3$) Amine R-$NH_2$, R-$NHR'$, R-$NR'R''$ -amine / Amino- Méthylamine ($CH_3NH_2$) Amide R-CO-$NH_2$ -amide / Carbamoyl- Éthanamide ($CH_3CONH_2$) Halogénoalcane R-X (X=F, Cl, Br, I) Halo- Chloroéthane ($CH_3CH_2Cl$) Isomérie Isomères de Constitution: Même formule brute, enchaînement différent. Isomérie de chaîne (butane vs isobutane) Isomérie de position (but-1-ène vs but-2-ène) Isomérie de fonction (éthanol vs méthoxyméthane) Stéréoisomères: Même formule brute, même enchaînement, arrangement spatial différent. Isomérie Géométrique (Z/E ou Cis/Trans): Due à la rigidité d'une double liaison ou d'un cycle. Z (Zusammen): Priorités les plus élevées du même côté. E (Entgegen): Priorités les plus élevées de côtés opposés. Isomérie Optique (Énantiomères): Molécules images l'une de l'autre dans un miroir, non superposables. Nécessite un carbone asymétrique (chiral). Carbone Asymétrique: Carbone lié à 4 substituants différents. Configuration R/S: Règle de Cahn-Ingold-Prelog (CIP). Dextrogyre (+): Fait tourner le plan de lumière polarisée vers la droite. Lévogyre (-): Fait tourner le plan de lumière polarisée vers la gauche. Mélange Racémique: Mélange équimolaire d'énantiomères (optiquement inactif). Diastéréoisomères: Stéréoisomères qui ne sont pas des énantiomères. Peuvent avoir des propriétés physiques différentes. Réactions Courantes 1. Réactions des Alcènes et Alcynes Hydrogénation Catalytique: Ajout de $H_2$ en présence d'un catalyseur (Pd, Pt, Ni). Alcène $\xrightarrow{H_2, Cat.}$ Alcane (syn addition) Alcyne $\xrightarrow{H_2, Cat.}$ Alcène $\xrightarrow{H_2, Cat.}$ Alcane Alcyne $\xrightarrow{H_2, Pd/BaSO_4}$ Alcène cis Halogénation: Ajout de $X_2$ (Cl, Br). Alcène $\xrightarrow{X_2}$ Dihalogénoalcane vicinal (anti addition) Hydrohalogénation: Ajout de HX (HCl, HBr, HI). Alcène $\xrightarrow{HX}$ Halogénoalcane. Règle de Markovnikov: H se fixe au carbone le plus hydrogéné. Peroxydes (ROOR) inversent Markovnikov pour HBr. Hydratation: Ajout de $H_2O$. Alcène $\xrightarrow{H_2O, H^+}$ Alcool (Markovnikov) 2. Réactions des Halogénoalcanes Substitution Nucléophile ($S_N1$, $S_N2$): Remplacement de l'halogène par un nucléophile. $S_N2$: Concertée, inversion de configuration, favorisée par substrat primaire, nucléophile fort, solvant aprotique polaire. $S_N1$: Deux étapes (carbocation), racémisation, favorisée par substrat tertiaire, nucléophile faible, solvant protique polaire. Élimination ($E1$, $E2$): Formation d'un alcène. $E2$: Concertée, anti-périplanaire, favorisée par base forte, substrat tertiaire/secondaire. Règle de Zaitsev (produit le plus substitué). $E1$: Deux étapes (carbocation), favorisée par substrat tertiaire, base faible/solvant protique. 3. Réactions des Alcools Oxydation: Alcool primaire $\xrightarrow{oxydant doux (PCC)}$ Aldéhyde Alcool primaire $\xrightarrow{oxydant fort (KMnO_4, CrO_3)}$ Acide Carboxylique Alcool secondaire $\xrightarrow{oxydant (CrO_3)}$ Cétone Alcool tertiaire: Ne s'oxyde pas facilement. Déshydratation: Alcène $\xleftarrow{H_2SO_4, \Delta}$ Alcool Réaction avec HX: Alcool $\xrightarrow{HX}$ Halogénoalcane ($S_N1$ ou $S_N2$) 4. Réactions des Composés Carbonylés (Aldéhydes et Cétones) Addition Nucléophile: Avec Grignard (R-MgX): $\xrightarrow{R-MgX, H_3O^+}$ Alcool (primaire si formaldéhyde, secondaire si aldéhyde, tertiaire si cétone) Avec Hydrures ($NaBH_4, LiAlH_4$): $\xrightarrow{Réduction}$ Alcool Avec HCN: $\xrightarrow{HCN}$ Cyanohydrine Oxydation (Aldéhydes): Aldéhyde $\xrightarrow{oxydant doux}$ Acide Carboxylique Réduction: Aldéhyde $\xrightarrow{NaBH_4}$ Alcool primaire Cétone $\xrightarrow{NaBH_4}$ Alcool secondaire 5. Réactions des Acides Carboxyliques et Dérivés Acidité: Acides faibles, réagissent avec les bases pour former des sels. Formation d'Esters (Estérification de Fischer): Acide Carboxylique + Alcool $\xrightarrow{H^+}$ Ester + $H_2O$ Hydrolyse d'Ester: Ester $\xrightarrow{H_2O, H^+}$ Acide Carboxylique + Alcool Formation d'Amides: Acide Carboxylique + Amine $\xrightarrow{\Delta}$ Amide + $H_2O$ Réduction: Acide Carboxylique $\xrightarrow{LiAlH_4}$ Alcool primaire Spectroscopie 1. Résonance Magnétique Nucléaire (RMN) - $^1H$ RMN Nombre de signaux: Indique le nombre de types de protons non équivalents. Déplacement Chimique ($\delta$ ppm): Position du signal, dépend de l'environnement électronique. Protons blindés: $\delta$ faible (vers la droite). Protons déblindés: $\delta$ élevé (vers la gauche). Alcanes: $0.9-1.7$ Alcools (CH-OH): $3.4-4.5$ Aldéhydes (CH-CHO): $9-10$ Acides Carboxyliques (COOH): $10-13$ Benzène: $6.5-8.0$ Intégration: Aire sous le pic, proportionnelle au nombre de protons équivalents. Couplage (Multiplicité): Nombre de voisins (n) donne $n+1$ pics (règle du $n+1$). Singulet (0 voisins), Doublet (1 voisin), Triplet (2 voisins), Quartet (3 voisins). 2. Spectroscopie Infrarouge (IR) Identification des groupes fonctionnels: Basée sur les vibrations des liaisons. OH (alcools/acides): Large, $3200-3600 \text{ cm}^{-1}$ C=O (carbonyles): Forte, $1650-1780 \text{ cm}^{-1}$ C$\equiv$C (alcynes): Faible, $2100-2260 \text{ cm}^{-1}$ C$\equiv$N (nitriles): Faible, $2200-2260 \text{ cm}^{-1}$ CH (alcanes): $2850-2970 \text{ cm}^{-1}$ NH ($1^\circ, 2^\circ$ amines): Moyenne, $3300-3500 \text{ cm}^{-1}$ (un ou deux pics) 3. Spectrométrie de Masse (SM) Masse Moléculaire: Pic de l'ion moléculaire ($M^+$). Fragmentation: Permet de déduire la structure par les fragments. Isotopes: Pics $M+1$ (présence de $^{13}C$), $M+2$ (Cl, Br). Cl: Rapport $M^+:(M+2)^+ \approx 3:1$ Br: Rapport $M^+:(M+2)^+ \approx 1:1$